1. 서 론
방사성 폐기물은 방사성 물질이 일정한 농도 이상으로 오염되어 있거나 오염되어 폐기의 대상이 되는 물질을 말한다. 이러한 방사성 폐기물은 원자력발전소, 산업체, 연구기관, 의학계열 등 원자력을 사용하는 모든 과정에서 발생한다. 현재 국내에는 5개 원자력 발전소에서 25개의 원자로가 가동 중이다. 현재 가동 중인 원자로의 수명은 약 20~40년이며 수명이 다한 원자로는 가동 중지-해체 준비-제염-해체-폐기물 처리의 해체 전 주기 과정을 거친다1,2).
원자력 발전소의 운영 및 해체 전 주기 과정에서 발생되는 방사성 폐기물은 탄소재, 무기재, 금속재 등 다양한 물질로 구성되어 있다. 원자력에 사용되는 금속 재료에는 철강, 알루미늄, 구리 등이 있지만 스테인리스강을 비롯한 철강재가 많은 부분을 차지하고 있다. 이러한 방사성 폐기물 중 금속은 재활용 가치가 높아 국내·외에서 리사이클링 업체로 유입되고 있다. 특히 국내에서 발생된 폐기물은 유입 경로를 파악할 수 있어서 비교적 관리가 쉽지만, 해외에서 유입되는 금속 폐기물은 발생처나 유입 경로의 파악이 곤란한 문제점이 있다. 금속 재료의 경우 재용해하여 리사이클링하면 용매 금속 외의 방사성핵종이 금속/슬래그/가스상으로 분배됨과 동시에 용매 금속은 감용화시켜 회수할 수 있는 장점이 있다. 그러나 슬래그상이나 가스상으로 분배되는 방사성핵종에 관한 정량적인 평가가 이루어져 있지 않아 금속 재료 재활용의 장애 요인이 되고 있다. 특히 방사성 폐기물의 제염에 관해서는 비교적 많은 연구들이 이루어져 있으나3,4), 각 상으로의 분배 평형에 관한 연구는 많지 않다. 또한 철강(스테인리스강 등)이나 비철금속에서 일반 불순물이나 귀금속 등의 분배에 관해서는 많은 연구가 이루어져 있으나5,6) 방사성핵종들에 관한 연구 결과는 매우 드문 실정이다7).
한편 천연방사성핵종인 238U, 235U, 232Th은 각각 우라늄계열, 토륨계열 방사성 붕괴계열을 갖고 있으며1), 방사성핵종의 붕괴로 인하여 생성된 자핵종 중 원자량이 210 및 212 g/mol인 Pb가 존재한다. 따라서 본 연구는 천연방사성핵종의 붕괴에 의해 생성된 Pb에 의해 오염된 철강을 재용해할 때 Pb의 분배거동에 관하여 조사하였다. Pb의 원자번호는 82번이며 안정한 원소의 원자량은 207.19 g/mol이지만 화학적 성질은 동위원소와 동일하다. 따라서 Fe 중에 안정한 Pb를 5 wt% 첨가하고 CaO-SiO2-Al2O3-MgO계 슬래그와 함께 용융시켜 Pb의 금속/슬래그/가스상으로의 분배 거동을 열역학적 계산과 함께 조사하였다.
2. 실험방법
방사성 폐기물 중 천연방사성핵종인 238U, 235U, 232Th의 붕괴로 인하여 생성된 자핵종 중 Pb에 의한 방사성 오염을 모사하기 위해 Fe에 안정한 Pb 5wt%를 첨가하여 금속 시료로 사용하였다. 용매인 Fe로는 타원소의 영향을 배제하기 위해 전해철을 사용하였다. Pb는 99 % Lead powder(DUKSAN사)를 Ar 분위기의 고주파 유도로에서 용융·응고 후 사용하였다.
슬래그는 시약급의 CaCO3, SiO2, Al2O3, MgO(DUKSAN사)를 사용하여 조제하였다. CaO는 CaCO3를 알루미나 도가니에 장입 후 전기로에서 대기 분위기의 1,273 K에서 10시간 동안 하소하여 사용하였다. 각 슬래그 조성의 산화물을 일정한 조성으로 혼합한 후 고주파 유도로를 이용하여 1,873 K의 Ar 분위기에서 2시간 동안 용융하고 노냉한 후 파쇄하여 사용하였다.
Fig. 1에는 CaO-SiO2-Al2O3-10 wt%MgO 4원계 슬래그의 상태도를 나타내었다. 일반적인 철강제련에서 사용하는 슬래그인 CaO-SiO2-Al2O3에 MgO 도가니의 침식을 방지하기 위해 10 wt%의 MgO를 첨가하여 저융점 슬래그를 조제하였다. 38 wt%CaO-32 wt%SiO2-20 wt%Al2O3-10 wt%MgO 슬래그의 융점은 약 1,723 K의 저융점이며 저점도 슬래그로 알려져 있다. 따라서 이 조성을 기준으로 20 wt%Al2O3, 10 wt%MgO를 고정하고 염기도(wt%CaO)/(wt%SiO2) 1.0~2.5 범위의 슬래그를 조제하여 사용하였다. 본 실험 조건에서 실험 후 MgO 도가니의 침식은 관찰되지 않았다.
Fig. 2에는 실험장치의 모식도를 나타내었다. 시료의 가열은 고주파 유도로(30 kW, 40 kHz)를 사용하였으며, 유도 코일 내에 내경=160 mm, 높이=590 mm의 석영관을 설치하였다. 석영관 내부에 외경=100 mm, 내경=80 mm, 높이=200 mm의 흑연 도가니를 설치하여 발열체로 사용하였고, 석영관과 흑연 도가니 사이에 내화솜을 삽입하여 외부로의 열손실을 방지하였다. 반응 도가니로는 외경=33 mm, 내경=27 mm, 높이=62 mm의 마그네시아(MgO) 도가니를 사용하였다. B-type 열전대를 반응 도가니 외부에 인접하게 삽입하여 온도를 ±2 ℃로 유지하였다. 상하부에 플렌지를 설치하고 Ar 가스를 송입하여 분위기를 유지하였다. Ar 가스는 Cu turning을 통과시켜 Ar 중 산소를 제거하여 사용하였으며, 유량은 MFC(Mass Flow Controller; MKS type 247)로 제어하였다.
마그네시아 도가니에 40 g의 Fe-5 wt%Pb와 20 g의 CaO-SiO2-Al2O3-MgO 슬래그를 장입하였다. Pb와 전해철, 슬래그 순으로 장입한 도가니를 발열체인 흑연 도가니 내부에 설치하고 Ar 분위기에서 목표 온도까지 10 K/min으로 승온하였다. 승온 완료 후 2 시간 동안 유지하였으며, 반응 종료 후 시료 및 도가니는 노냉하였고, 응고된 금속과 슬래그를 분리하고 파쇄하여 회수하였다. 회수한 금속은 드릴링(drilling)하여 칩 형태로 만들고 슬래그는 파쇄하여 각각을 유도결합플라즈마분광분석기(Inductively Coupled Plasma Spectrometry, ICP, Optima 7300DV & Avio500, PerkinElmer)로 금속 및 슬래그 중 Pb 농도를 분석하였다.
3. 실험결과 및 고찰
3.1. Fe 중 Pb 용해도
Fe-Pb 2원계 합금에 관한 연구는 1900년대부터 시작되었으나, 납이 철강의 유용 성분이 아니어서 거의 연구되지 않았다. 다만 1940년대에 원자로 노재면에서 용융 Pb에 의한 Fe의 부식 속도나 용해도가 측정되었다. 그리고 용철 중 Pb의 용해도는 Pb 함유 쾌삭강 제조에 관한 것이 일부 알려져 있으나, 더이상 Pb 쾌삭강을 제조하지 않으므로 최근의 연구 결과는 많지 않다.
Fig. 3에는 Fe-Pb 2원계 상태도를 나타내었다. 철강 정련온도에서 Fe-Pb는 2액상인 것을 알 수 있다. 그리고 Pb가 많은 쪽의 상태도에 관해서는 비교적 잘 알려져 있다8). 본 연구에서는 Fe 중 Pb 용해도에 관하여 주목하고 있지만 Fe가 많은 쪽의 상태도에 관해서는 그다지 잘 알려져 있지 않다.
그동안 Pb는 고체 및 액체 Fe 중에 용해되지 않는 것으로 알려져 왔으며, 최근에 몇몇 결과가 보고되었으나 Pb의 증기압이 높아 실험결과의 신뢰성에는 약간의 문제점이 남아 있다9). Araki 등은 Pb 함유 쾌삭강에 대해 검토하여 1,527 ℃ 이하에서는 Fe 중 Pb 용해도가 사실상 0에 가깝지만, 실질적으로 1,550 ℃ 이하에서는 약 0.05 wt%, 1,570~1,600 ℃에서는 0.12~0.21 wt% 정도인 것으로 보고하였다10). 그 이상의 온도에서는 Pb의 증발량이 급증하지만 이론적인 용해도도 증가하는 것으로 보고하였다. 그리고 Morozov 등은 Fe 중 Pb 용해도에 관하여 온도의 함수로 다음 식을 제안하였다11).
한편 Kubaschewski는 Fe 중 Pb 용해도에 관하여 다음 식을 제안하였다12).
Burton은 Fe-Pb 2원계에서 Fe 중 Pb 용해도를 조사하여 Fe rich측의 상태도를 검토하였다13). Fig. 4에는 Burton의 결과를 wt%로 환산한 Fe rich측 상태도를 식 (1)의 Morozov 및 식 (2)의 Kubaschewski가 제안한 식과 함께 나타내었다. Fig. 4로부터 Araki 등10)의 보고와 같이 온도가 상승함에 따라 Pb 용해도가 증가하는 것을 알 수 있다.
3.2. Fe 중 Pb의 분배 거동
Fig. 5에는 1,873 K, Ar 분위기에서 슬래그 염기도에 따른 금속, 슬래그 중 Pb 농도의 변화를 나타내었다. 슬래그 염기도가 증가할수록 금속상 중 Pb 농도가 약간 증가하는 경향을 보였다. 슬래그 중 Pb 농도는 염기도가 증가함에 따라 감소하는 경향을 보였으나, 염기도 1.8 이상에서는 슬래그 중 Pb가 검출한계인 20 ppm 이하를 나타내었다. PbO-SiO2 2원계에서 PbO의 활동도는 라울 법칙에서 음으로 편기하고, 특히 SiO2가 높을 때는 매우 낮은 값을 나타낸다14). 그리고 Bi-Pb/Bi2O3-PbO-SiO2계에서 SiO2 농도가 증가할수록 Pb의 분배비가 증가(슬래그 중 Pb 농도 증가)하는 경향을 나타내어6) 본 연구의 결과와 유사한 경향을 나타내는 것으로 생각된다. 한편 식 (2)에 나타낸 Kubaschewski가 제안한 식으로부터 1,873 K에서 Fe 중 Pb 용해도는 0.385 wt%로 본 실험의 염기도 1~1.8 조건에서의 Fe 중 Pb 농도보다 약간 낮은 값이지만 실험방법의 차이에 의한 것으로 생각된다.
Fig. 6에는 슬래그 염기도에 따른 Pb의 슬래그와 금속상 사이의 분배비 을 나타내었으며, 은 다음 식과 같이 구하였다.
여기서 (wt%M)slag와 [wt%M]metal은 각각 슬래그와 금속상 중 Pb 농도를 나타낸다. 슬래그 염기도가 증가함에 따라 Pb 분배비인 이 감소하는 경향을 나타내었으며, 염기도가 1.8 이상일 때는 그림에 나타낸 바와 같이 슬래그 중에 Pb가 검출되지 않아 ‘0’으로 나타내었다. 슬래그 중 (SiO2) 농도가 증가하면 염기성 산화물인 PbO가 강산성인 SiO2와 결합되어 화합물을 생성하므로 슬래그 중 PbO 농도가 증가한다6). 본 실험에서도 염기도가 증가함에 따라 슬래그 중 SiO2 농도가 감소하여 슬래그 중 PbO 농도는 감소하고 Fe 중 Pb는 증가하였기 때문으로 생각된다.
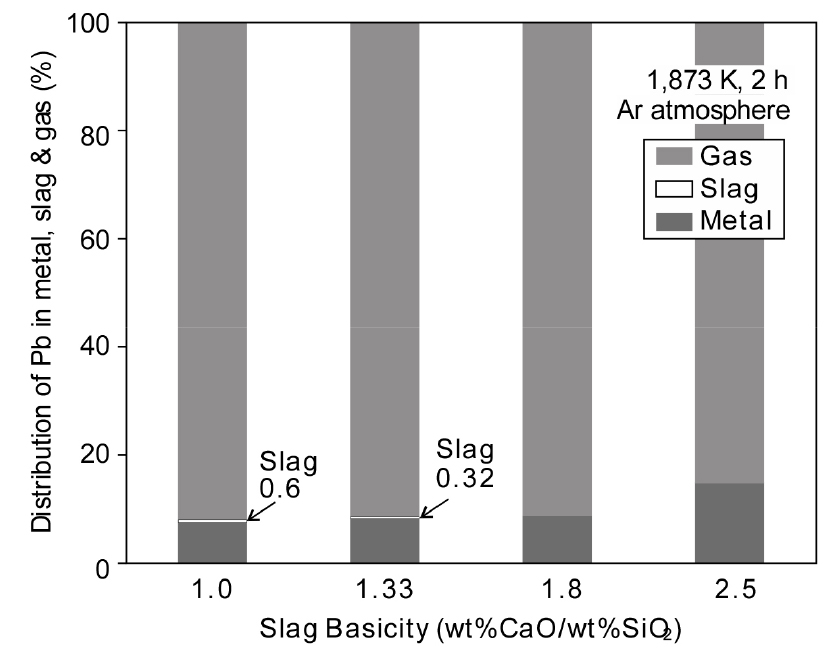
Fig. 7에는 슬래그 염기도에 따른 Pb의 금속/슬래그/가스상으로의 분배 비율을 나타내었다. 가스상 분배율은 초기 Fe 중 Pb(5 wt%)에서 금속, 슬래그 상에서 검출된 Pb의 농도를 제외한 나머지를 가스상으로 분배되었다고 가정하여 구하였다. 슬래그 염기도가 증가함에 따라 금속상으로 분배되는 비율이 증가하였으며, 슬래그 염기도가 낮을 때는 슬래그상으로 약 0.3~0.6 wt% 분배되었으나 염기도가 1.8 이상일 때는 슬래그 중 Pb가 검출한계 이하를 나타내었다. 한편 슬래그 염기도 증가에 따라 금속상으로 분배되는 Pb의 비율이 증가하면서 가스상으로 분배되는 비율이 감소하였으나, 용융 Fe 중 Pb의 93~85 %는 가스상으로 분배되었다. 다만 이러한 가스상으로의 분배 비율은 초기 Pb 함유량에 의존한다.
3.3. Fe-Pb 중 Pb 분배 거동의 열역학적 고찰
Fe와 슬래그 중 Pb의 분배는 식 (4), (5)에 나타낸 PbO와 FeO의 생성반응으로부터 고찰할 수 있다.
여기서 Pb와 Fe가 동일한 분위기(산소 분압)하에 있는 경우 Fe-Pb/FeO-PbO계를 고려한 평형 반응식은 다음과 같이 나타낼 수 있다.
식 (6)의 평형상수는 다음과 같다.
식 (7)에서 ( )와 [ ]는 각각 슬래그 및 금속상 중의 성분을 나타내며, 는 성분의 활동도(activity)이며, 와 는 각각 다음과 같다.
여기서 는 성분의 몰 수(mol), 는 성분의 활동도계수(activity coefficient)이다. 식 (8), (9)를 식 (7)에 대입하면 는 1로 가정할 수 있으므로 평형상수는 다음과 같이 나타낼 수 있다.
위의 식으로부터 Pb 분배비인 은 다음과 같다.
따라서 는 평형상수와 각상의 양, 그리고 Pb와 PbO의 활동도계수, 슬래그 중 FeO의 활동도에 의존한다.
한편 100 g 슬래그의 전체 몰 수는 약 1.4717)이며, 본 실험에 사용한 20 g 슬래그의 은 0.294이다. 그리고 금속상(Fe)은 약 35 g이므로 이며, 18)이며, 1,873 K에서 이므로 평형상수 는 2.37×10-3이다. 따라서 각각을 식 (11)에 대입하면 와 에 따른 을 구할 수 있다.
Fig. 8에는 와 에 따른 의 계산 결과와 염기도 1~1.33에서 구한 실험결과를 비교하여 나타내었다. 동일한 에서는 슬래그 중 증가에 따라 이 증가하며, 가 일정할 때는 의 증가에 따라 이 급격하게 감소하지만, 가 일정 값 이상이되면 에 미치는 영향은 낮게 나타났다. 이러한 결과는 슬래그 중 가 증가하면 산소 퍼텐셜이 증가하여 슬래그 중 PbO의 농도가 증가하기 때문인 것으로 생각된다.
본 연구의 슬래그 조성과는 차이가 있으나 Matsura 등은 슬래그(CaO-SiO2-FeOx) 중 FeOx 농도에 따라 는 약 0.3~2.0인 것으로 보고하였다19). 그리고 Marouka 등은 CaO-SiO2-FetO-Al2O3-MgO계 슬래그 중 는 염기도에 따라 감소하며 FetO 농도가 낮을수록 가 낮으며, 슬래그 염기도가 0.8~1.3에서 는 약 1.6인 것으로 보고하였다. 본 실험 조건에서는 슬래그 중에 별도의 FetO를 첨가하지 않았으나 실험 후 슬래그 중에 약 2 wt%의 FeO가 함유되어 있었다. 따라서 는 약 0.1 이하의 낮은 값으로 추정된다. 따라서 실험 결과와 계산 결과를 비교하면 슬래그 중 PbO의 활동도계수와 무관하게 은 매우 낮은 값이며 실험 결과와 계산 결과가 유사한 수준에 있는 것으로 추정된다. 특히 식 (6)의 로부터 Fe-Pb가 공존할 때 Fe가 우선적으로 산화되므로 슬래그 중 PbO의 농도는 매우 낮을 것으로 예상된다. 그리고 PbO의 끓는점이 1,750 K으로 본 실험 온도보다 낮은 값이므로 생성된 PbO도 쉽게 증발되어 슬래그 중 Pb 함유량이 매우 낮게 나온 것으로 생각된다.
한편 Fig. 7에 나타낸 바와 같이 Pb의 대부분은 기상으로 분배되었다. 이러한 Pb의 기상 분배에 관하여 열역학적으로 검토하였다. 우선 Fe-Pb 2원계에서 Pb의 증기압은 다음과 같다.
따라서 용질 Pb의 증기압은 순수상태의 증기압 , Fe-Pb계에서의 활동도계수 가 필요하며, 는 다음과 같다20).
그리고 1,873 K에서 18)이므로 각각의 값을 식 (12)에 대입하면 Fe 중 Pb 농도에 따른 Pb의 증기압을 구할 수 있다. Fig. 9에는 Fe 중 Pb 농도()를 wt%로 환산하여 Pb 농도에 따른 Pb 증기압 변화를 나타내었다. 그리고 비교를 위해 식 (13)에 나타낸 순 Pb의 증기압을 함께 나타내었다. 본 실험(B=1~1.33)의 Fe 중 Pb 함유량으로부터 구한 증기압은 순 Pb의 증기압(0.444 atm)보다는 낮은 값이지만 약 0.4 atm으로 비교적 높은 값으로 Fe 중 Pb의 대부분이 증발되어 기상으로 분배되는 것을 알 수 있다. 따라서 Fig. 7에 나타내 바와 같이 Fe 중 Pb의 80~90 %가 증발되어 기상으로 분배된 것으로 생각된다. 그리고 Fe-Pb가 Fig. 3에 나타낸 바와 같이 1,873 K에서 2액상으로 분리되어 있고 Fe 중 Pb의 용해도도 매우 낮기 때문으로 생각된다.
한편 평형상태의 용융 금속 표면에서 용질 금속 B의 단위 시간당, 단위 면적당 증발량(g)인 증발속도()는 기체분자 운동론에 의한 다음의 Langmuir식으로 나타낸다21).
임의의 온도에서 용매인 Fe 중 용질인 Pb의 상대적인 증발속도는 다음과 같다.
여기서 는 다음과 같다22).
식 (15)에서 Fe의 활동도는 1로 둘 수 있으며, 1,873 K에서 는 0.039 atm이며 는 0.444 atm이므로 는 약 11.39이고, 는 1.93이므로 Pb의 상대적인 증발속도는 다음과 같다.
여기서 Fe 중 Pb는 2액상으로 분리되므로 5 wt% 첨가한 Pb의 활동도를 1로 가정하면 Pb의 증발 속도는 Fe의 약 22배가 되어 Fe보다 Pb가 우선 증발되므로 Fe-Pb 중 Pb의 80~90 %가 기상으로 분배된 것으로 생각된다.
4. 결 론
본 연구는 Fe-5 wt%Pb와 CaO-SiO2-Al2O3-MgO계 슬래그를 함께 용융시켜 Pb의 금속/슬래그/가스상으로의 분배 거동을 열역학적 계산과 함께 조사한 것으로 결과를 종합하면 다음과 같다.
1) 슬래그 염기도가 증가함에 따라 Fe 중 Pb 용해도는 0.37~0.74 wt%로 비교적 낮은 값이지만 약간 증가하는 경향을 나타내었으며, 슬래그 중 Pb는 감소하는 경향을 나타내었으나 염기도가 1.8 이상일 때는 슬래그에서 Pb는 검출한계 이하를 나타내었다.
2) 염기도 증가에 따라 슬래그 중 SiO2 농도가 감소하여 Pb의 슬래그/금속 사이의 분배비가 감소하는 경향을 나타내었다.
3) Pb의 슬래그/Fe상 중 분배비는 슬래그 중 PbO의 활동도계수와 무관하게 매우 낮으며, 열역학적 계산 결과와 실험 결과는 유사한 수준을 나타내었다.
4) 본 실험 조건에서 Fe 중 Pb의 증기압은 약 0.4 atm으로 비교적 높은 값이며, Pb의 증발속도는 Fe의 약 22배에 달하여 Fe 중 Pb의 대부분이 기상으로 증발되었다.